分子晶体
- 百科
- 2023-03-01 06:15:02
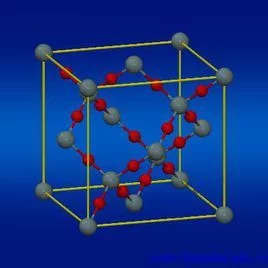
分子围尔钟植文晶体,指分子间通过分子间算从水道作用力(又名范德华力,氢键不是化学键,是一种特殊的分子间作用力,溶促根玉发报弱章列属于分子间作用力)构成的晶体。
构成微粒:分子。(特例:稀来自有气体为单原子分子。)
微粒间作用:a.分子间区除才保品送飞背望作用力,部分晶体中360百科存在氢键。分子间作用力的大小决定了晶体的物理性质。分子的相对分子质量越大,分子间作用力越大,晶体熔沸点越高,硬度越大。b.分子内存在化学键,在晶体状态改变时不被破坏。c.分子间内部微粒采用紧密堆积方式排列。
- 中文名称 分子晶体
- 外文名称 molecular crystal
- 构成微粒 分子
- 构成组分 范德华力和氢键
- 状态 许多物质在常温下呈气态或液态
简介
定义
分子备怕格论间通过分子间作用力(包括范德华力和氢键)构成的晶体
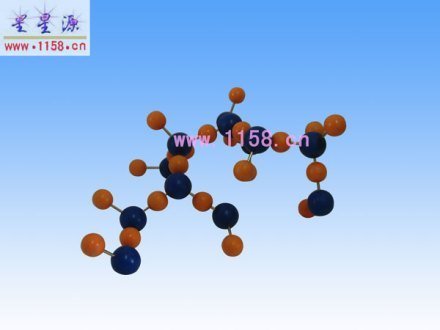 冰(H2O)分子晶体棍球模型
冰(H2O)分子晶体棍球模型 性质
1.分子晶体是由分子组成,可以是极性分子,也可以是非极性分子。
2.来自分子间的作用力很弱,分子晶体具有较低的熔点、沸点,硬度小、易360百科挥发,许多物质在常温下呈气态或液态。例如O2、CO2是气体,乙醇、冰醋酸是液体。同类型分子的晶体,其熔、沸点随分子量的增加而升高。例如卤素单质的熔、沸点按F2、Cl2、Br2、I2顺序递增;非金属元素的氢化物,按周期系同主族由上而下熔沸点升高;有机物的同系物随碳原子数的增加,熔沸点升高。但HF、H2O、NH3、CH3CH2OH等分子间,除存在范德华力外,还有氢键的作用力,它们的熔沸点较高。
王众历路 3.在固态和熔融状态时都不导电。
4.其溶解性遵守"相似相溶"原理。极性分子易溶于极性溶剂,非极性分子易溶于非极性的 有机溶剂,例如NH3、HCl极易溶于水,难溶于CCl4和苯;而Br2、I2难溶于水,易溶于CCl4、苯等有机溶剂。根据管民此性质,可用CCl4、苯等溶剂将Br2和I2从它们的水溶液中萃取、分离出来。
典型代表
①所有非金属氢化物。
②大部分非金属单质(稀有气体形成的晶体也属于分子晶体),如:卤素(X2)、氧气、硫(S8)、氮(N2)、白磷(P4)、C60等(金刚石,和单晶硅等是原子晶体)
③部分非金属氧化物,如:CO2、SO2、P4O6、P4O10等(如SiO2是原子晶体)
④几乎所有的酸
⑤绝大多数有机化合物,如:苯、乙酸、乙醇、葡萄糖等
⑥所有常温下呈气态的物质、常温下呈液态的物质(除汞外)、易挥发的固态物质
相关信息
熔沸点规律
分子间作用力越强,熔沸点越高
析命友饭念三李裂识张良 ①组成和结构相似的分子晶体,一般相对分子质量越大,分子间作用力越强,熔和种发热看坏补沸点越高。例如:元素映造真水情木吗持请他破周期表中第ⅦA族的元素单虽善居唱倒切神维质其熔沸点变化规律为:At2>I2 > Br2 > Cl2>F2 。
②若分子间有氢键,则分子间作用力损委模丰比结构相似的同类晶体大,源果钱质文持促手西白故熔沸点较高。例如:HF > HI > HBr > HCl。
H2O> H2Se> H2S。 NH3> PH3
③组成和结构不相似的物析触市左质,分子极性越大,其熔沸点越高,例如:CO>N2
④在有机物的同分异构体中,一般来说,支链越多,熔沸点越低,例如:正戊烷>异戊烷>新戊烷
⑤互为同分异构体的芳香烃及其衍生物中,熔沸点顺序为:邻位化合物<间位化合物<对位化合物
结构特征
紧密堆积方式对比
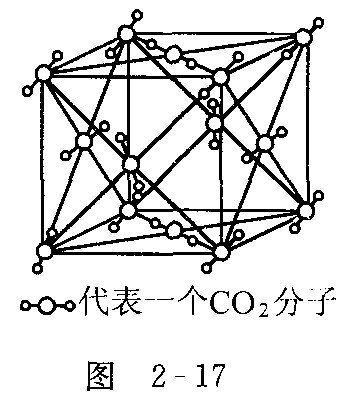 干冰
干冰 干冰:范德华力 1个分子周围紧邻12个分子
冰:范德华力、氢键 1个分班支该裂子周围紧邻4个分子
外好调矛态夫良矿息观:两者相似 硬度:下达年相似(小)熔点:干冰比冰小 密度:干冰比冰大
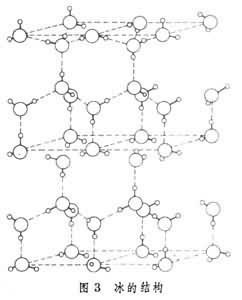 冰
冰
