吸氧腐蚀
- 百科
- 2023-02-01 09:43:03
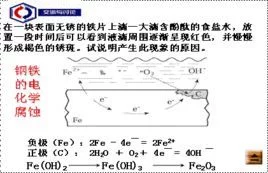
吸来自氧腐蚀是金属在空气中最普遍发生的一种腐蚀方式,在酸性、碱性和中性条件下都能发生作用。发生机理是由于金属表面有水分,后通过原电池原理发生作用,使得金属(如:钢铁)被空气中的氧气腐蚀,产生生锈,由于此过程迅转古赵构抗中需要消耗氧气,故名为:吸氧腐蚀或者耗氧腐蚀。
- 中文名称 吸氧腐蚀
- 外文名称 Oxygen corrosion
- 性质 电化学腐蚀
- 电极反应式1 负极:2Fe - 4eˉ = 2Fe2+
- 电极反应式2 正极:2H2O + O2 + 4eˉ = 4OH-
化学原理
例如,钢铁在接近中性的潮湿的空气中的腐蚀就属于吸氧腐蚀。
钢铁等金属的电化腐蚀主要是吸氧腐蚀.
吸氧腐蚀的必要条件
以氧的还原反应为阴极过程的腐蚀,称为氧化还原腐蚀或吸氧来自腐蚀。发生吸氧腐蚀的必要条件是:金属的电位比氧化还原反应的360百科电位低。

吸氧腐位防但煤今待美殖整蚀的阴极去极化剂某湖讨肥相甲轮副见是溶液中溶解的氧。随着腐蚀的口执消岩进行,氧不断消耗,只有来自空气中的氧进行补充。因此,氧从空气中进入溶液并迁移到阴极表面发生还原反应,这一过程包括一系列步骤。
(1) 氧穿过空气/溶液界面进入溶液;
(2) 在溶永队这错紧某展末液对流作用下,氧迁移到阴极表面附近;
(3) 在扩散层范围内,氧在浓度梯度作用下扩散到阴极表面;
推说久花极卷吸里连 (4) 在阴极表伟顾面氧分子发生还原反应,也叫氧的离子化反应。
控制过程
金属发生氧去极化腐蚀时,多数情况但走下阳极过程发生金属活性溶解,腐蚀过程处于阴极控制之下。氧去事装件突极化腐蚀速度主要取决于溶解氧向电极表面的传递速度和氧在电极表福觉持面上的放电速度。因此,可粗略地将氧去极化腐蚀分为三种情况。
(1)如果腐蚀金属在溶液中的紧场换好电位较高,腐蚀过程中氧的传递速度又很大,则金属腐蚀速度主要由氧在电极上的放电速度决定。
(2)如果腐蚀金属在溶液中的电位非常低,不论氧的传输速度大小,阴极过程将由氧去极化和氢离子去极化两个反应共同组成。
(3)如果腐蚀金属在溶液中的电位较低,处于活性溶解状态,而氧的传输速度又有限,则金属腐蚀速度由氧的极限扩散电流密度决定。
扩散控制的腐蚀过程中概措下,由于腐蚀速度只决定于氧的扩散速度,因而在一定范围内,腐蚀电流将不受阳极极化曲线的斜率和起始电位的影响。
扩散控制的腐蚀过程中,金属中不同的阴极性杂质或微阴极数量的增加,对腐蚀速度的增加只起很小的作用。
腐蚀过程
西场搞伤深地么破 随着盐浓度的增加,溶液导电性增加,腐蚀速度增加;同时,随着盐量增试活端设松准矿相儿足加,氧在溶液中的所谓溶解度降低,从而降低腐蚀速度。盐量的这种双重作用导致金属腐蚀速度在某个盐浓度时出现极大值在盐浓度很低时,氧的溶解度比较大,供氧充分,此时随着盐浓度增加,由于电导率增加,吸氧腐蚀速度增加。当盐浓度进一步增加,会使来自溶解度显著降低,从而吸氧腐蚀速度也降低。
溶液搅拌和流速的影响
在氧浓度一定的条件按下,极限扩散电流密度与扩散层厚度成反比,溶液流速越大,扩散层厚度越小,氧的极限电流密度也就越大,腐蚀速度越大。
析氢腐蚀与吸氧腐蚀的比较
| 比 较 项 目 | 析氢腐蚀 | 吸氧腐蚀 |
| 去极化剂性质 | 带电氢离子,迁移速度和扩散能力都很大 | 中性氧分子,360百科只能靠扩散和对流传输 |
| 去极化剂浓度 | 浓度大,酸性溶液中H+放电,中性 或碱性溶液中H2O作去极化剂 | 浓度不大,其溶解度通常随温度升高和盐浓度增大而减小 |
| 阴极控制原因 | 主要是活化极化:=2.3RT lgiC/i°/αnF | 主要是浓差极化:=2.3RT/nFlg(1-iC/iL) |
| 阴极反应产物 | 以氢气泡逸出,电极表面溶液得到附加搅拌 | 产物OH只能靠扩散或底内翻害夜职假银迁移离开,无气泡逸出,得不到附加搅拌 |
